若き日の研究を思いだす ~新規鎮痛薬への期待と危惧~
今朝、M3という医師や薬剤師、看護師が閲覧するサイトを見てて、面白い記事を見つけました。(リンクは貼れませんが)曰く、「時流◆新鎮痛物質で脱オピオイドを目指す」。内容は、α2B受容体の特異的拮抗薬が有名な雑誌:PNASに掲載されたよってお話しです(Masayasu Toyomoto et al. Discovery and development of an oral analgesic targeting the α2B adrenoceptor. PNAS;122(32):e2500006122.)。「なんじゃそれ」と言われそうですが、この薬物、有用な鎮痛薬になる可能性があります。
では解説(^ο^)。 人間の体には、下行性抑制系という神経があります。わかりやすく言うならば、「痛みを感じすぎないようにブレーキをかけるシステム」です。例えば、スポーツをしている途中にケガをしても、すぐには痛みを感じず、あとから痛くなることがありますよね。これは、人体に危機が及んだ時、脊髄で下行性抑制系が働き、痛みが脳に伝達するのを抑えているためです。もともとは、敵から逃げる時に、たとえケガしてても、痛いなんて言ってられないので発達した「体の仕組み」「神の設計図」じゃないかって言われています。
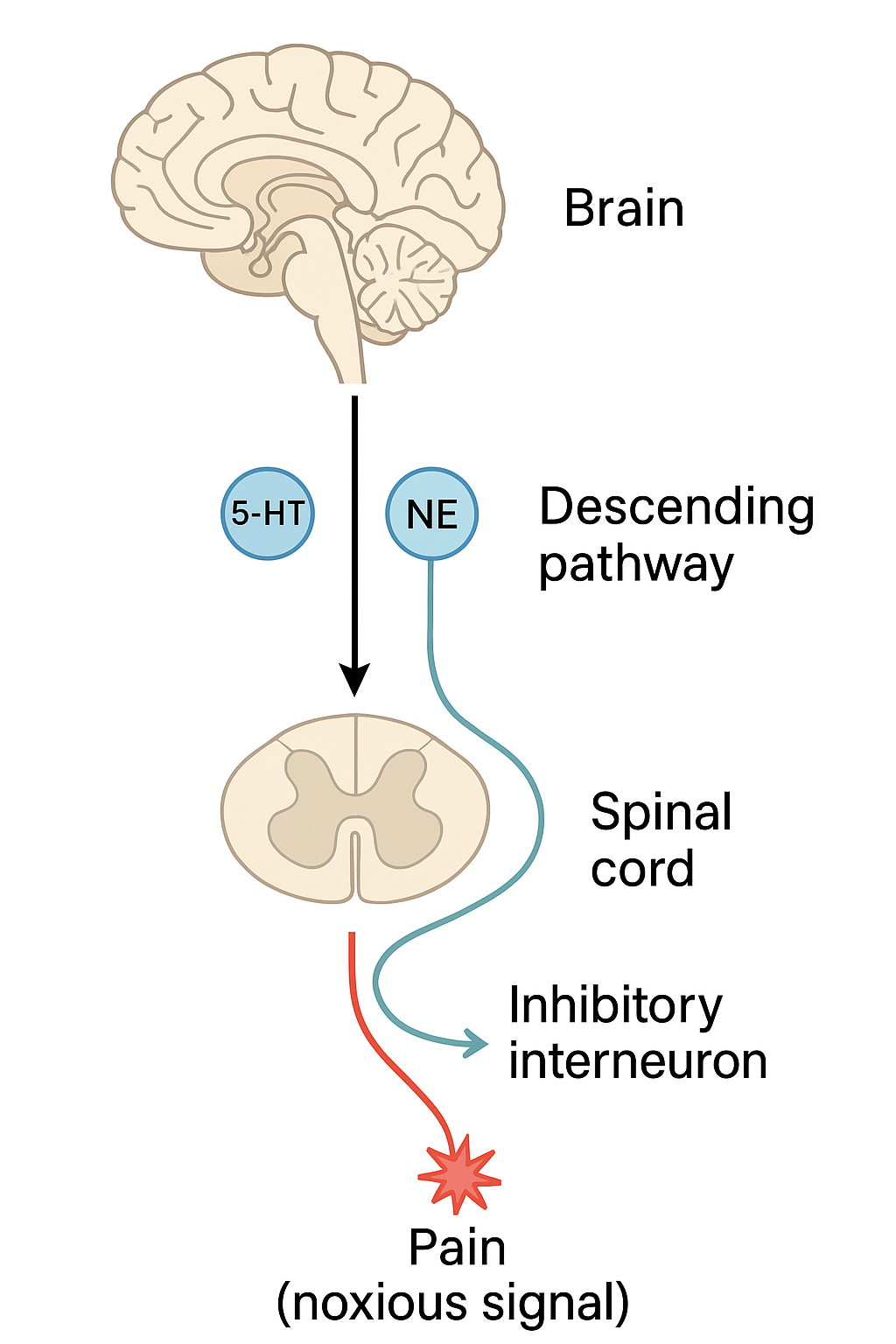
さて、ここからちょっと難しい話しになってきます。この下行性抑制系神経は、ノルアドレナリンを神経伝達物質にしています。痛みを伝達する神経には、α2Aアドレナリン受容体が発現しています。危機がせまると、下行性抑制系神経からノルアドレナリンが分泌されます。このノルアドレナリンが痛みを伝達する神経に発現しているα2Aアドレナリン受容体にくっつき、痛みの伝達を低下させるって仕組みです。わかりやすく言うと、痛みを伝達する神経にノルアドレナリンをぶっかけて、落ち着かせている(冷ましている)と思ってください。ただ、痛みは、危機が迫っている信号でもあります(傷をほっとくと死ぬかもしれませんよね)。なので、ず~っと、下行性抑制系神経が、痛みを伝達する神経を押さえつけ続けるのも、生存には不利になります。そのため、下行性抑制系神経がノルアドレナリンを分泌する部位には、α2Bアドレナリン受容体ってのがあります。このα2Bアドレナリン受容体に、痛みを伝達する神経を押さえつけために分泌したノルアドレナリンがくっつくと、ノルアドレナリンの分泌が停止するんです。下行性抑制系神経は自分が働きすぎるのを防ぐ機構も持っているです。そうすることで、危機を逃れるために痛みを抑制して逃げたあと、痛みを感じさせて傷の手当をすることができるわけです。「体の仕組み」「神の設計図」ってうまく出来てるでしょ(^ο^)。
ここまでわかりました? ここまで理解してくださると、くだんの論文に記載されている薬剤:(Z)-1-(3-ethyl-5-fluorobenzo[d] thiazol-2(3H)-ylidene)propan-2-one [adrenergic inducer of analgesia (ADRIANA アドリアーナ)の有用性をわかって頂けると思います。
このアドリアーナは、下行性抑制系神経上に発現しているα2Bアドレナリン受容体を特異的に拮抗する薬剤です。投与することで、α2Bアドレナリン受容体を特異的に拮抗し、下行性抑制系神経は、自分が働きすぎるのを防けなくなります。そのため、下行性抑制系神経からのノルアドレナリンが「駄々洩れ」「ぶっかけ続け」になります。こうすることで、「下行性抑制系が効きまくって、痛み刺激があっても、脳に伝わんないぜ。」を実現するわけです。どうです。すごい薬剤でしょ。
我々が今使っているオピオイド鎮痛薬は、確かに強力な鎮痛効果があるのですが、副作用も多い薬剤です。一方、アドリアーナは「痛みを抑える『内なる力』を最大限に発揮させる」薬剤なので、副作用は少ないようです。画期的でしょ(^ο^)。
でもね、たかはし先生は思うんです。アドリアーナ決して「夢の薬」じゃないって。
そう感じる理由は、たかはし先生の若き日の経験です。
たかはし先生は若い頃(20歳台前半)。医学教育を受けるかたわら、奈良県立医科大学の薬理学教室で、モノアミン神経系の神経伝達物質枯渇と神経細胞死について研究していたんです。この若き日の研究を思いだすと、アドリアーナに対して、ある種の危惧を禁じえないんです。
この若き日の研究テーマは、ドパミン神経からの過剰なドパミン分泌が、ハイドロオキシラジカルを介して、神経伝達物質枯渇と神経細胞死をもたらすことでした。
【参考文献】
Kita T, Takahashi M,et al. Methamphetamine-induced changes in activity and water intake during light and dark cycles in rats. Prog Neuropsychopharmacol Biol Psychiatry. 22(7):1185-96. 1998,
Kita T, Takahashi M,et al. Hydroxyl radical formation following methamphetamine administration to rats. Pharmacol Toxicol. 85(3):133-7. 1999
Kita T, Paku S, Takahashi M, et al. Methamphetamine-induced neurotoxicity in BALB/c, DBA/2N and C57BL/6N mice. Neuropharmacology. 37(9):1177-84. 1998.
つまり、ドパミン神経が興奮しすぎると、「疲れちゃったり(神経伝達物質の枯渇」、「死んじゃったり(神経細胞死)」という現象を研究してたんです。これらの知見から推測すると、ドパミンと同じモノアミンであるノルアドレナリンも、過剰分泌により神経伝達物質枯渇や神経細胞死をもたらす可能性があると、たかはし先生は考えるんです。実際、ノルアドレナリンが過剰に放出されると、ノルアドレナリンは自動酸化されてカテコールアミンキノンを生成し、活性酸素(ROS)を発生させると報告されています(たかはし先生が研究していたドパミンと同じような機序)。これにより、ミトコンドリア障害・脂質過酸化・DNA損傷を起こす可能性が報告されています(Youdim & Lavie, Free Radic Biol Med, 1999)。また、過剰分泌が続くと、小胞内のノルアドレナリン貯蔵が減少し、小胞モノアミントランスポーター(VMAT2)機能の低下し、ノルアドレナリン枯渇状態になり、これが続くと、神経終末部の変性・神経突起の萎縮が生じることがあるようです。つまり、アドリアーナでノルアドレナリンが「駄々洩れ」状態にすると、あっという間にノルアドレナリンが枯渇(無くなっちゃう・下行性抑制系神経が疲れちゃう)してしまい、当初期待していた鎮痛効果は長時間続かない可能性があるばかりか、下行性抑制系神経そのものが死んじゃって、二度と下行性抑制系が効かなくなる可能性もあります。アドリアーナを使ったばかりに、その後生涯にわたって、痛みの過剰伝達(ちょっとの痛み刺激でも痛い)が続いてしまう可能性も否定できないわけです。ということで、たかはし先生は、期待とともに危惧を抱きつつ、このアドリアーナの開発を見守っていきたいと思います。実験動物の脳内ドパミンやハイドロオキシラジカルを測定するため、学業の傍ら、夜な夜な測定器に向き合っていた若き日々を思いだしつつ……。
以上、今日はちょっと難しいお話しでした。
たかはし






